Fasten, Hormonhaushalt und Innere Uhr
Veröffentlicht am
Chronobiologie Ernährung
Dass Fasten dabei helfen kann, Zivilisationskrankheiten vorzubeugen und Beschwerden zu lindern, ist mittlerweile allgemein bekannt. Doch was passiert beim Fasten eigentlich?
Eine interessante Studie (1) beleuchtet die Wirkung auf den Hormonhaushalt und geht dabei insbesondere auf die Rolle der Inneren Uhr ein.
Zirkadianer Rhythmus
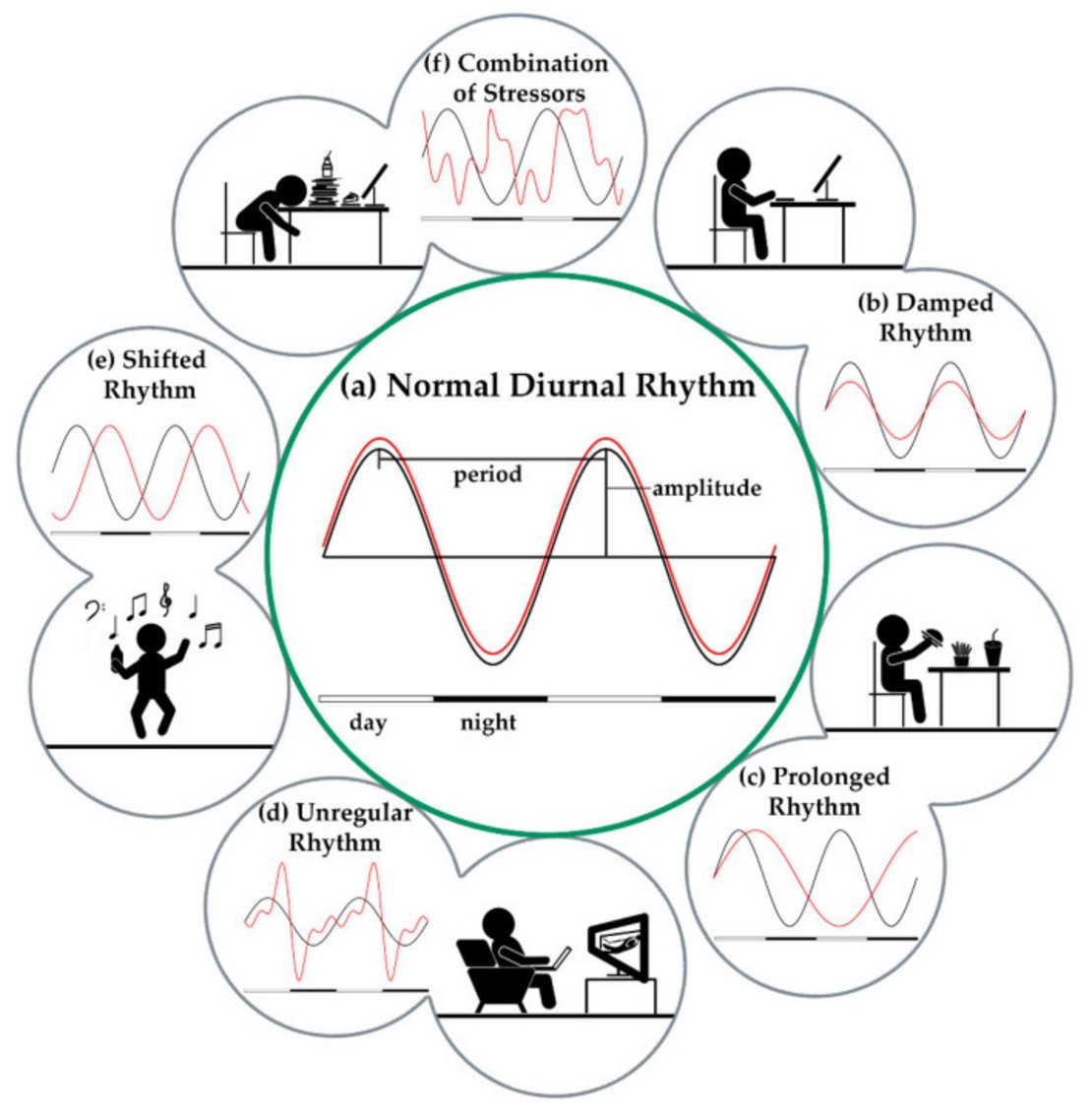
Mit zirkadianem Rhythmus (von lat. circa = ungefähr und dies = Tag) wird die Fähigkeit des Organismus beschrieben, seine physiologischen Vorgänge auf eine Periode von etwa 24 Stunden zu synchronisieren. Synonym verwendet werden oft die Begriffe 'Biorhythmus' oder auch 'Innere Uhr'. Die 'Schaltzentrale' für diese Innere Uhr befindet sich im Gehirn (Nucleus suprachiasmaticus), wobei die einzelnen Organe ihrerseits auch über eigene 'Uhren' in Form von bestimmten Genen bzw. Körperzellen verfügen. Damit sie gleich laufen, ist ein gegenseitiger Austausch notwendig, der v.a. hormonell vermittelt wird. Der zirkadiane Rhythmus als Gesamtheit metabolischer und hormoneller Prozesse ist damit ein komplexes System, das von zentralem und peripheren Taktgebern beeinflusst wird – aber ebenso durch externe Faktoren.
So wurden Menschen schon in der Steinzeit durch den Tag-Nacht-Zyklus der Erde, das Sonnenlicht, beeinflusst und richteten ihren Wach-Schlaf- bzw. Aktivitäts-Ruhe-Zyklus darauf aus. Zusätzlich sorgten begrenzte Möglichkeiten der Nahrungsbeschaffung, längere Perioden ohne Nahrungsaufnahme dafür, dass unser Körper möglichst effizient mit der ihm zur Verfügung stehenden Energie umgeht. Die Notwendigkeit von Energieeinsparung resultierte etwa in ausgedehnteren Schlafenszeiten.
Schlafstörungen
Ursachen für schlechten Schlaf und Tipps, wie man entsprechend für einen guten Schlaf sorgen kann
Ursachen für schlechten Schlaf und Tipps, wie man entsprechend für einen guten Schlaf sorgen kann
Michael Elies · Annette Kerckhoff · Ulrich Koch
ISBN: 978-3-96562-020-9
Erscheinungsjahr: 2020, 3. Aufl.
6,90 EUR
Zum Shop »In den westlichen Industrienationen des 21. Jahrhunderts nun gibt es Nahrung im Überfluss, noch dazu erfordert der moderne Lebensstil oftmals nur wenig Bewegung, ist aber vom natürlichen Licht in großen Teilen unabhängig geworden. Der Körper ist evolutionär bedingt jedoch noch immer darauf ausgerichtet, effizient hauszuhalten und überschüssige Energie für schlechtere Zeiten einzuspeichern. Genau darin sehen WissenschaftlerInnen sogenannte Zivilisationskrankheiten wie Diabetes oder Übergewicht begründet. (2-4)
Externe Störfaktoren der Inneren Uhr
Immer wenn der zirkadiane Rhythmus durch externe Faktoren so beeinflusst wird, dass er von seinem natürlichen Lauf abweicht, hat dies physische (metabolische Belastung) und psychische (kognitive Leistungsfähigkeit und geistige Gesundheit) Konsequenzen. (5)
Als Risikofaktor für Erkrankungen gilt beispielsweise ein versetzter Rhythmus des Schlafhormons Melatonin. (6,7) Normalerweise nimmt das Melatonin-Level am Morgen ab und geht dann einher mit der Bildung von Kortisol. Bei Schicht-ArbeiterInnen lässt sich jedoch unmittelbar nach dem Aufwachen schon ein erhöhter Kortisol-Spiegel (8) sowie eine gestiegene absolute Kortisol-Konzentration (9) nachweisen, was auf eine gestörte Reaktion auf Licht-Reize schließen lässt – und zwar bereits nach nur fünf Tagen Nachtarbeit. (10)
Schichtarbeit beeinflusst darüber hinaus die Produktion von Ghrelin und Leptin. Leptin ist ein von Fettgewebe produziertes Sättigungshormon, das das Körpergewicht reguliert; das Stoffwechselhormon Ghrelin kann als dessen Antagonist verstanden werden. Höhere Ghrelin-Level verringern die Fettverbrennung, was zu einer Zunahme von Fettgewebe und gesteigerter Nahrungsaufnahme führt (11), während höhere Leptin-Level einen angemessenen Ernährungsstatus repräsentieren. (12) Bei Menschen, die verkürzte Schlafzeiten haben, finden sich verringerte Leptin- und erhöhte Ghrelin-Spiegel (13), wodurch Stoffwechselerkrankungen begünstigt werden. (14)
Zu fettiges Essen, zu wenig Bewegung, zu wenig Schlaf, unregelmäßige Schlafenszeiten, generell ein unregelmäßiger Lebensstil – das alles kann den zirkadianen Rhythmus aus dem Takt bringen.
Fasten als Taktgeber
Die 'zentrale Innere Uhr' Nucleus suprachiasmaticus beeinflusst den Metabolismus in den peripheren Organen durch Hormone, aber umgekehrt beeinflussen die Organzellen mit ihren eigenen 'kleinen Uhren', bestimmten Genen, auch den Nucleus suprachiasmaticus. Es handelt sich um eine bidirektionale Steuerung. So konnte gezeigt werden, dass eine Störung des zirkadianen Rhythmus ihre Ursache sowohl in dem Versatz der zentralen Inneren Uhr zu den üblichen Licht-Dunkel-Zyklen haben kann, als auch gleichermaßen in Abweichungen der peripheren metabolischen Prozesse. (15) Da Intermittierendes Fasten nachweislichen Einfluss auf den Hormonhaushalt und metabolische Prozesse hat (16-19), kann es ein Mittel sein, über diesen Weg wieder in einen geordneten zirkadianen Rhythmus zu finden.
So spielen Insulin und Glukagon beispielsweise eine große Rolle für den zirkadianen Rhythmus. Insulin ist das blutzuckersenkende Hormon, Glukagon dient hingegen der Bereitstellung von Glukose, um Energiereserven zu mobilisieren. Während Fastenzeiten werden beide Hormone durch den Nucleus suprachiasmaticus reguliert, um den Blutzuckerspiegel konstant zu halten. Nach einer Mahlzeit steigt das Glukose-Level an, die Insulin-Ausschüttung wird angeregt. Beim Essen jedoch nehmen die 'Uhr-Gene' der Zellen wiederum Einfluss auf die Insulin- und Glukagon-Ausschüttung. (20)
Heilfasten
Hinweise für das stationäre Heilfasten und Selbsthilfetipps für die häusliche Fastenkur in modifizierter Form
Hinweise für das stationäre Heilfasten und Selbsthilfetipps für die häusliche Fastenkur in modifizierter Form
Annette Kerckhoff · Thomas Rampp
ISBN: 978-3-96562-011-7
Erscheinungsjahr: 2020, 2. Aufl.
6,90 EUR
Zum Shop »Intermittierendes Fasten reduziert den Nüchtern-Insulin-Spiegel, was für eine verbesserte Insulinempfindlichkeit spricht. (21,22) Da die Insulinempfindlichkeit im Tagesverlauf abnimmt (23,24), bietet es sich an, die zeitlich begrenzte Nahrungsaufnahme in den Morgen zu legen, um Stoffwechselerkrankungen vorzubeugen. Schon die Verlegung der Essenszeit kann also einen Reset der peripheren Organuhren herbeiführen, mit dem sich die aktiven und inaktiven Phasen der Inneren Uhr wieder verschieben lassen. (25,26)
Neben dem Zeitpunkt der Nahrungsaufnahme wirkt sich darüber hinaus auch die Art des Fastens auf den Metabolismus aus. Bei 16 Stunden Fasten und einem Fenster von 8 Stunden für die Nahrungsaufnahme lässt sich bereits nach acht Wochen ein gesteigerter Adiponektin-Level feststellen, bei gleichzeitig verringertem Leptin-Spiegel. (27) Adiponektin wird in den Fettzellen gebildet und sensibilisiert das Gewebe für Insulin. (28) Bei Menschen mit höherem Körpergewicht ist der Adiponektin-Spiegel höher, was zu einer Insulin-Resistenz und zu mehr Körperfett führt. (29-31) Das Zusammenspiel von Leptin und Schlafenszeiten ist weiter oben bereits angesprochen worden.
Fazit
Gerät die Innere Uhr aus dem Gleichgewicht, dann steigt das Risiko für Zivilisationserkrankungen. Tatsächlich führt unser moderner Lebenswandel leicht zu einer Verschiebung der aktiven und passiven Phasen unseres Biorhythmus. Fasten ist ein Mittel, um die Innere Uhr wieder zu regulieren – aber nicht das einzige. Neben der Nahrungsaufnahme sind ausreichend Bewegung und eine Schlafroutine weitere 'Stellschrauben', die idealerweise aufeinander abgestimmt sind und sich gegenseitig ergänzen bzw. verstärken. Dies unterstreicht die Bedeutung eines ganzheitlichen Ansatzes in der Prävention und Therapie einmal mehr.
Literatur zu "Fasten, Hormonhaushalt und Innere Uhr"
(1) Haupt S, Eckstein ML, Wolf A, Zimmer RT, Wachsmuth NB, Moser O. Eat, Train, Sleep-Retreat? Hormonal Interactions of Intermittent Fasting, Exercise and Circadian Rhythm. Biomolecules. 2021 Mar 30;11(4):516. doi: 10.3390/biom11040516. PMID: 33808424; PMCID: PMC8065500. Link
(2) Dobbs R., Sawers C., Thompson F., Manyika J., Woetzel J., Child P., McKenna S., Spatharou A. Overcoming Obesity: An Initial Economic Analysis. The McKinsey Global Institute; New York, NY, USA: 2014. Link
(3) Bergouignan A., Rudwill F., Simon C., Blanc S. Physical inactivity as the culprit of metabolic inflexibility: Evidence from bed-rest studies. J. Appl. Physiol. 2011;111:1201–1210. doi: 10.1152/japplphysiol.00698.2011. Link
(4) Kohl H.W., Craig C.L., Lambert E.V., Inoue S., Alkandari J.R., Leetongin G., Kahlmeier S. The pandemic of physical inactivity: Global action for public health. Lancet. 2012;380:294–305. doi: 10.1016/S0140-6736(12)60898-8. Link
(5) Vogel M., Braungardt T., Meyer W., Schneider W. The effects of shift work on physical and mental health. J. Neural Transm. 2012;119:1121–1132. doi: 10.1007/s00702-012-0800-4. Link
(6) Sack R.L., Blood M.L., Lewy A.J. Melatonin Rhythms in Night Shift Workers. Sleep. 1992;15:434–441. doi: 10.1093/sleep/15.5.434. Link
(7) Roden M., Koller M., Pirich K., Vierhapper H., Waldhauser F. The circadian melatonin and cortisol secretion pattern in permanent night shift workers. Am. J. Physiol. Integr. Comp. Physiol. 1993;265:R261–R267. doi: 10.1152/ajpregu.1993.265.1.R261. Link
(8) Li J., Bidlingmaier M., Petru R., Gil F.P., Loerbroks A., Angerer P. Impact of shift work on the diurnal cortisol rhythm: A one-year longitudinal study in junior physicians. J. Occup. Med. Toxicol. 2018;13:1–9. doi: 10.1186/s12995-018-0204-y. Link
(9) Manenschijn L., Van Kruysbergen R.G.P.M., De Jong F.H., Koper J.W., Van Rossum E.F.C. Shift Work at Young Age Is Associated with Elevated Long-Term Cortisol Levels and Body Mass Index. J. Clin. Endocrinol. Metab. 2011;96:E1862–E1865. doi: 10.1210/jc.2011-1551. Link
(10) Leese G., Chattington P., Fraser W., Vora J., Edwards R., Williams G. Short-term night-shift working mimics the pituitary-adrenocortical dysfunction in chronic fatigue syndrome. J. Clin. Endocrinol. Metab. 1996;81:1867–1870. doi: 10.1210/jcem.81.5.8626849. Link
(11) Meier U., Gressner A.M. Endocrine Regulation of Energy Metabolism: Review of Pathobiochemical and Clinical Chemical Aspects of Leptin, Ghrelin, Adiponectin, and Resistin. Clin. Chem. 2004;50:1511–1525. doi: 10.1373/clinchem.2004.032482. Link
(12) Rohner-Jeanrenaud F., Jeanrenaud B. The discovery of leptin and its impact in the understanding of obesity. Eur. J. Endocrinol. 1996;135:649–650. doi: 10.1530/eje.0.1350649. Link
(13) Taheri S., Lin L., Austin D., Young T., Mignot E. Short Sleep Duration Is Associated with Reduced Leptin, Elevated Ghrelin, and Increased Body Mass Index. PLoS Med. 2004;1:e62. doi: 10.1371/journal.pmed.0010062. Link
(14) Ulhôa M.A., Marqueze E.C., Burgos L.G.A., Moreno C.R.C. Shift Work and Endocrine Disorders. Int. J. Endocrinol. 2015;2015:1–11. doi: 10.1155/2015/826249. Link
(15) Mazzoccoli G., Pazienza V., Vinciguerra M. Clock Genes and Clock-Controlled Genes in the Regulation of Metabolic Rhythms. Chronobiol. Int. 2012;29:227–251. doi: 10.3109/07420528.2012.658127. Link
(16) Longo V.D., Panda S. Fasting, circadian rhythms, and time-restricted feeding in healthy lifespan. Cell Metab. 2016;23:1048–1059. doi: 10.1016/j.cmet.2016.06.001. Link
(17) Mendoza J. Circadian Clocks: Setting Time By Food. J. Neuroendocr. 2007;19:127–137. doi: 10.1111/j.1365-2826.2006.01510.x. Link
(18) Longo V.D., Mattson M.P. Fasting: Molecular Mechanisms and Clinical Applications. Cell Metab. 2014;19:181–192. doi: 10.1016/j.cmet.2013.12.008. Link
(19) Chaix A., Zarrinpar A., Miu P., Panda S. Time-Restricted Feeding Is a Preventative and Therapeutic Intervention against Diverse Nutritional Challenges. Cell Metab. 2014;20:991–1005. doi: 10.1016/j.cmet.2014.11.001. Link
(20) Kalsbeek A., la Fleur S., Fliers E. Circadian control of glucose metabolism. Mol. Metab. 2014;3:372–383. doi: 10.1016/j.molmet.2014.03.002. Link
(21) Sutton E.F., Beyl R., Early K.S., Cefalu W.T., Ravussin E., Peterson C.M. Early time-restricted feeding improves insulin sensitivity, blood pressure, and oxidative stress even without weight loss in men with prediabetes. Cell Metab. 2018;27:1212–1221.e3. doi: 10.1016/j.cmet.2018.04.010. Link
(22) Jamshed H., Beyl R.A., Della Manna D.L., Yang E.S., Ravussin E., Peterson C.M. Early time-restricted feeding improves 24-hour glucose levels and affects markers of the circadian clock, aging, and autophagy in humans. Nutrients. 2019;11:1234. doi: 10.3390/nu11061234. Link
(23) Yoshino J., Almeda-Valdes P., Patterson B.W., Okunade A.L., Imai S.-I., Mittendorfer B., Klein S. Diurnal Variation in Insulin Sensitivity of Glucose Metabolism Is Associated With Diurnal Variations in Whole-Body and Cellular Fatty Acid Metabolism in Metabolically Normal Women. J. Clin. Endocrinol. Metab. 2014;99:E1666–E1670. doi: 10.1210/jc.2014-1579. Link
(24) Carrasco-Benso M.P., Rivero-Gutierrez B., Lopez-Minguez J., Anzola A., Diez-Noguera A., Madrid J.A., Lujan J.A., Martínez-Augustin O., Scheer F.A.J.L., Garaulet M. Human adipose tissue expresses intrinsic circadian rhythm in insulin sensitivity. FASEB J. 2016;30:3117–3123. doi: 10.1096/fj.201600269RR. Link
(25) Damiola F., Le Minh N., Preitner N., Kornmann B., Fleury-Olela F., Schibler U. Restricted feeding uncouples circadian oscillators in peripheral tissues from the central pacemaker in the suprachiasmatic nucleus. Genes Dev. 2000;14:2950–2961. doi: 10.1101/gad.183500. Link
(26) Hara R., Wan K., Wakamatsu H., Aida R., Moriya T., Akiyama M., Shibata S. Restricted feeding entrains liver clock without participation of the suprachiasmatic nucleus. Genes Cells. 2001;6:269–278. doi: 10.1046/j.1365-2443.2001.00419.x. Link
(27) Moro T., Tinsley G., Bianco A., Marcolin G., Pacelli Q.F., Battaglia G., Palma A., Gentil P., Neri M., Paoli A. Effects of eight weeks of time-restricted feeding (16/8) on basal metabolism, maximal strength, body composition, inflammation, and cardiovascular risk factors in resistance-trained males. J. Transl. Med. 2016;14:1–10. doi: 10.1186/s12967-016-1044-0. Link
(28) Kadowaki T., Yamauchi T., Kubota N., Hara K., Ueki K., Tobe K. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J. Clin. Investig. 2006;116:1784–1792. doi: 10.1172/JCI29126. Link
(29) Behre C. Adiponectin: Saving the starved and the overfed. Med. Hypotheses. 2007;69:1290–1292. doi: 10.1016/j.mehy.2007.02.044. Link
(30) Jung S.H., Park H.S., Kim K.-S., Choi W.H., Ahn C.W., Kim B.T., Kim S.M., Lee S.Y., Ahn S.M., Kim Y.K., et al. Effect of weight loss on some serum cytokines in human obesity: Increase in IL-10 after weight loss. J. Nutr. Biochem. 2008;19:371–375. doi: 10.1016/j.jnutbio.2007.05.007. Link
(31) Anderlová K., Kremen J., Dolezalová R., Housová J., Haluzíková D., Kunesová M., Haluzík M. The influence of very-low-calorie-diet on serum leptin, soluble leptin receptor, adiponectin and resistin levels in obese women. Physiol. Res. 2006;55:277–283. Link

Im rhythmischen Wechsel von Tag und Nacht, von Licht und Dunkelheit … Wann sind wir fit und leistungsfähig?

Gerät die Innere Uhr aus dem Gleichgewicht, steigt das Risiko für Zivilisationserkrankungen. Fasten ist…

Nach der Traditionellen Chinesischen Medizin hat jedes Organ seine Arbeits- und Ruhezeiten.

Von der Wissenschaft als Mythos abgetan, ist ein gestörter Schlaf bei Vollmond für viele Menschen Realität.

Über den Einfluss des Mondes auf das Schlafverhalten und den Menstruationszyklus.